Gas ideal
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
| Termodinamika |
|---|

Mesin panas klasik Carnot
|
Pada kondisi normal seperti temperatur dan tekanan standar, kebanyakan gas nyata berperilaku seperti gas ideal. Banyak gas seperti nitrogen, oksigen, hidrogen, gas mulia dan karbon dioksida dapat diperlakukan seperti gas ideal dengan perbedaan yang masih dapat ditolerir.[1] Secara umum, gas berperilaku seperti gas ideal pada temperatur tinggi dan tekanan rendah,[1] karena kerja yang melawan gaya intermolekuler menjadi jauh lebih kecil bila dibandingkan dengan energi kinetik partikel, dan ukuran molekul juga menjadi jauh lebih kecil bila dibandingkan dengan ruangan kosong antar molekul.
Model gas ideal tak dapat dipakai pada suhu rendah atau tekanan tinggi, karena gaya intermolekuler dan ukuran molekuler menjadi penting. Model gas ideal juga tak dapat dipakai pada gas-gas berat seperti refrigeran atau gas dengan gaya intermolekuler kuat, seperti uap air. Pada beberapa titik ketika suhu rendah dan tekanan tinggi, gas nyata akan menjalani fase transisi menjadi liquid atau solid. Model gas ideal tidak dapat menjelaskan atau memperbolehkan fase transisi. Hal ini dapat dijelaskan dengan persamaan keadaan yang lebih kompleks.
Gas ideal termodinamika klasik
 (pada n dan T konstan); Hukum Charles:
(pada n dan T konstan); Hukum Charles:  (pada P dan n konstan); dan Hukum Avogadro:
(pada P dan n konstan); dan Hukum Avogadro:  (pada P dan T konstan). Dengan menggabungkan ketiga hukum tersebut, maka menjadi
(pada P dan T konstan). Dengan menggabungkan ketiga hukum tersebut, maka menjadi  yang artinya
yang artinya  .
.Pada kondisi ideal,
 ; maka,
; maka,  .
.Energi dalam gas ideal dinyatakan dengan: :

dengan
-
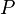 tekanan
tekanan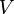 volume
volume jumlah substansi gas dalam mol
jumlah substansi gas dalam mol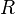 konstanta gas
konstanta gas temperatur mutlak
temperatur mutlak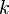 konstanta Hukum Boyle
konstanta Hukum Boyle konstanta proporsional, sama dengan
konstanta proporsional, sama dengan 
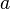 konstanta proporsional, sama dengan
konstanta proporsional, sama dengan 
 energi dalam
energi dalam kapasitas panas spesifik pada volume konstan, ≈ 3/2 untuk gas monoatom, 5/2 untuk gas diatom dan 3 untuk molekul lain yang lebih kompleks. Untuk mengubah dari besaran makroskopik ke mikroskopik, maka digunakan
kapasitas panas spesifik pada volume konstan, ≈ 3/2 untuk gas monoatom, 5/2 untuk gas diatom dan 3 untuk molekul lain yang lebih kompleks. Untuk mengubah dari besaran makroskopik ke mikroskopik, maka digunakan

-
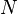 adalah jumlah partikel gas
adalah jumlah partikel gas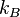 adalah konstanta Boltzmann (1.381×10−23J·K−1).
adalah konstanta Boltzmann (1.381×10−23J·K−1).
Hukum ideal gas adalah lanjutan dari hukum gas yang ditemukan secara percobaan. Fluida nyata pada densitas rendah dan temperatur tinggi hampir mengikuti hukum gas ideal. Namun, pada temperatur rendah atau densitas tinggi, fluida nyata mengalami penyimpangan jauh dari sifat gas ideal, terutama karena terkondensasi menjadi liquid atau terdeposisi menjadi padat. Penyimpangan ini dinyatakan dalam faktor kompresibilitas.
Model gas ideal mengikuti asumsi berikut ini:
-
- Molekul gas tidak dibedakan, berukuran kecil, dan berbentuk bola
- Semua tabrakan antar gas bersifat elastis dan semua gerakannya tanpa friksi (tidak ada energi hilang pada gerakan atau tabrakan)
- Menggunakan hukum Newton
- Jarak rata-rata antar molekul jauh lebih besar daripada ukuran molekul
- Molekul secara konstan bergerak pada arah acak dengan distribusi kecepatan
- Tidak ada gaya atraktif atau repulsif antara molekul atau sekitarnya
Referensi
- ^ a b Cengel, Yunus A.; Boles, Michael A. Thermodynamics: An Engineering Approach (ed. Fourth). hlm. 89. ISBN 0-07-238332-1.

Tidak ada komentar:
Posting Komentar